Vstavaná databáza certifikátov pre SSL v aplikácii TheBat od istého času prestáva (z nejakého dôvodu) fungovať správne.
Pri kontrole príspevkov sa objaví chyba:
Neznámy certifikát CA
Server v relácii nepredložil koreňový certifikát a zodpovedajúci koreňový certifikát sa nenašiel v adresári.
Toto spojenie nemôže byť tajné. Rado sa stalo
kontaktujte svojho správcu servera.
A existuje výber z odpovedí - ÁNO / NIE. A tak zakaždým, keď si zložíte poštu.
Rozhodnutie
V takom prípade musíte v aplikácii TheBat nahradiť implementačný štandard S / MIME a TLS programom Microsoft CryptoAPI!
Pretože som potreboval spojiť všetky súbory do jedného, \u200b\u200bnajskôr som všetky previedol súbory doc do jedného súbor PDF (cez programy Acrobat) a potom sa prevedie do fb2 prostredníctvom online prevodníka. Súbory môžete prevádzať aj osobitne. Formáty môžu byť úplne ľubovoľné (zdroj) a dokumenty vo formáte doc, jpg a dokonca aj vo formáte zip!
Názov stránky zodpovedá podstate :) Online Photoshop.
Aktualizácia máj 2015
Našiel som ďalšiu skvelú stránku! Ešte pohodlnejšie a funkčnejšie pre vytvorenie úplne svojvoľnej koláže! Toto je webová stránka http://www.fotor.com/en/collage/. Využite to na svoje zdravie. A sám to využijem.
Tvárou v tvár môjmu životu s opravou elektrického sporáka. Už som toho veľa urobil, veľa som sa naučil, ale nejako som mal málo spoločného s dlaždicami. Bolo potrebné vymeniť kontakty na ovládacích prvkoch a horákoch. Vyvstala otázka - ako určiť priemer horáka na elektrickom sporáku?
Odpoveď bola jednoduchá. Nemusíte nič merať, môžete ľahko určiť, akú veľkosť potrebujete.
Najmenší horákje 145 milimetrov (14,5 centimetra)
Stredná platnička je 180 milimetrov (18 centimetrov).
A na záver najviac veľký horák je 225 milimetrov (22,5 centimetra).
Stačí určiť veľkosť podľa oka a pochopiť, aký priemer potrebujete horák. Keď som to nevedel, vzlietol som s týmito rozmermi, nevedel som, ako zmerať, po ktorej hrane sa mám navigovať atď. Teraz som múdry :) Dúfam, že som pomohol aj vám!
V živote som stál pred takouto úlohou. Myslím si, že nie som jediný.
Tu si môžete zadarmo stiahnuť periodickú tabuľku, ktorú môžete nastaviť ako pozadie pracovnej plochy, alebo vytlačiť na tlačiarni. Ďalej uvádzame výber najkvalitnejších možností sťahovania v najvyššom možnom rozlíšení. Nižšie uvedené súbory samozrejme nie sú príliš vhodné na tlač na veľké formáty, ako sú A2, A1, A0, ale môžu byť vhodné na tlač na formáty A4 alebo A3. Ak chcete plagát normálnej kvality veľká veľkosť, na dobrom papieri a farbách prvotriednej kvality odporúčam pozrieť si možnosti dostupné na predaj na stránke „Kde kúpiť periodickú tabuľku“.
Súbory na stiahnutie na tejto stránke sú rozdelené do troch kategórií: dlhodobé, krátke a ďalšie.
Dlhodobá možnosť (moderná).
Skvelá moderná možnosť. Kvalita obrazu je bohužiaľ trochu príliš tesná. Autor zjavne niekde používa pôvodnú verziu obchodné účely... Vhodné pre čiernobiela tlač na formáte A4.
Obsahuje 114 prvkov, pre každý z nich môžete vidieť názov prvku v ruštine, angličtine a latinčine, počet, atómovú hmotnosť, teploty topenia a varu, elektronegativita podľa Paulinga a Allreda, distribúcia elektrónov podľa energetických úrovní;
Veľkosť obrázka: 1796x1111;
Formát súboru: JPG;
 Periodická tabuľka od amerického zberateľa chemika, autora knihy „Crazy Science“. Zvláštnosťou tejto publikácie je, že každá bunka prvku obsahuje obraz jednoduchej látky, ktorá mu zodpovedá, alebo výrobok z jednoduchej látky tohto prvku... V prípade transuranických krátkodobých prvkov vidíme portrét vedca, podľa ktorého je pomenovaný.
Periodická tabuľka od amerického zberateľa chemika, autora knihy „Crazy Science“. Zvláštnosťou tejto publikácie je, že každá bunka prvku obsahuje obraz jednoduchej látky, ktorá mu zodpovedá, alebo výrobok z jednoduchej látky tohto prvku... V prípade transuranických krátkodobých prvkov vidíme portrét vedca, podľa ktorého je pomenovaný.
Obsahuje 118 prvkov s minimálne informácie: symbol prvku, meno, číslo a vzhľad... Obrázok sa veľmi dobre hodí ako tapeta na plochu.
Veľkosť obrázka: 1173x605;
Formát súboru: JPG;
 Variant periodického systému v štýle uznávaného televízneho seriálu Breaking Bad. Navrhol Ciaran Nash. Napriek tomuto zdanlivo minimalistickému dizajnu táto tabuľka obsahuje všetky potrebné údaje o každom prvku: symbol prvku, číslo, relatívnu atómovú hmotnosť, rozdelenie elektrónov podľa úrovní. Tabuľka však zároveň neobsahuje názvy prvkov, preto nie je vhodná ako učebná pomôcka.
Variant periodického systému v štýle uznávaného televízneho seriálu Breaking Bad. Navrhol Ciaran Nash. Napriek tomuto zdanlivo minimalistickému dizajnu táto tabuľka obsahuje všetky potrebné údaje o každom prvku: symbol prvku, číslo, relatívnu atómovú hmotnosť, rozdelenie elektrónov podľa úrovní. Tabuľka však zároveň neobsahuje názvy prvkov, preto nie je vhodná ako učebná pomôcka.
Obrázok obsahuje 118 prvkov, dokonca je na ňom vyznačené livermorium a flerovium, na rozdiel od iných možností. H zle vhodné pre tých, ktorí už dobre poznajú chémiu, ako aj krásna tapeta na pracovnej ploche.
Veľkosť obrázka: 2560x1309;
Formát súboru: JPG;
Krátkodobá možnosť (stará).
 Krátka verzia periodickej tabuľky v minimalistickom štýle. Napriek jednoduchému vzhľadu obsahuje táto verzia veľa užitočná informácia: názov prvku v ruštine a angličtine, číslo, relatívna atómová hmotnosť, elektronická konfigurácia. Táto forma tabuľky sa v súčasnosti považuje za zastaranú, ale tí, ktorí pomocou nej študovali chémiu, budú zvyknutí používať túto možnosť.
Krátka verzia periodickej tabuľky v minimalistickom štýle. Napriek jednoduchému vzhľadu obsahuje táto verzia veľa užitočná informácia: názov prvku v ruštine a angličtine, číslo, relatívna atómová hmotnosť, elektronická konfigurácia. Táto forma tabuľky sa v súčasnosti považuje za zastaranú, ale tí, ktorí pomocou nej študovali chémiu, budú zvyknutí používať túto možnosť.
Vrátane 111 položiek. Vhodné pre tlač vo formátoch A4 a A3, rovnako ako tapety na plochu.
Veľkosť obrázka: 2864x2370;
Späť v škole, sediac na hodinách chémie, si všetci pamätáme stôl na stene triedy alebo chemického laboratória. Táto tabuľka obsahovala klasifikáciu všetkých chemických prvkov známych ľudstvu, tých základných zložiek, ktoré tvoria Zem a celý vesmír. Potom sme si to ani nemohli myslieť periodická tabuľka nepochybne jeden z najväčších vedecké objavy, ktorá je základom našich moderných poznatkov z chémie.
Periodická tabuľka chemických prvkov D. I. Mendeleeva
Na prvý pohľad vyzerá jej nápad klamne jednoduchý: usporiadať chemické prvky v poradí zvyšovania hmotnosti ich atómov. Navyše sa vo väčšine prípadov ukazuje, že chemické a fyzikálne vlastnosti každého prvku sú podobné predchádzajúcemu prvku v tabuľke. Tento vzorec sa prejavuje pre všetky prvky, s výnimkou prvých párov, jednoducho preto, že pred nimi nie sú prvky podobné atómovej hmotnosti. Vďaka objavu takejto vlastnosti môžeme umiestniť lineárnu postupnosť prvkov do tabuľky veľmi podobne ako nástenný kalendár, a tak kombinovať veľké množstvo typy chemických prvkov v jasnej a koherentnej forme. Samozrejme, dnes používame koncept atómového čísla (počet protónov), aby sme usporiadali sústavu prvkov. To pomohlo vyriešiť tzv technický problém „Páry permutácií“ však neviedli k radikálnej zmene v podobe periodickej tabuľky.
IN periodická tabuľka Mendelejeva všetky prvky sú zoradené podľa ich atómového čísla, elektronickej konfigurácie a opakujúcich sa chemických vlastností. Riadky v tabuľke sa nazývajú bodky a stĺpce sa nazývajú skupiny. Prvá tabuľka s rokom 1869 obsahovala iba 60 prvkov, ale teraz bolo treba tabuľku zväčšiť, aby sa do nej zmestilo 118 prvkov, ktoré dnes poznáme.
Periodická tabuľka Mendelejeva systematizuje nielen prvky, ale aj ich najrôznejšie vlastnosti. Chemikovi často stačí, aby mal pred očami Periodickú tabuľku, aby správne odpovedal na veľa otázok (nielen otázok zo skúšok, ale aj vedeckých).
ID YouTube 1M7iKKVnPJE je neplatné.
Periodický zákon
Existujú dve formulácie periodický zákon chemické prvky: klasické a moderné.
Klasická, ako ju predstavil jej objaviteľ D.I. Mendelejev: vlastnosti jednoduchých telies, ako aj tvary a vlastnosti zlúčenín prvkov, sú periodicky závislé od hodnôt atómových hmotností prvkov.
Moderné: vlastnosti jednoduchých látok, ako aj vlastnosti a formy zlúčenín prvkov sú periodicky závislé od náboja jadra atómov prvkov ( sériové číslo) .
Grafickým znázornením periodického zákona je periodická sústava prvkov, ktorá predstavuje prirodzenú klasifikáciu chemických prvkov na základe pravidelných zmien vlastností prvkov z nábojov ich atómov. Najbežnejšie obrázky periodickej tabuľky prvkov D.I. Mendelejev sú krátke a dlhé formy.

Skupiny a obdobia periodického systému
Podľa skupín sa nazývajú zvislé riadky v periodickej sústave. V skupinách sa prvky kombinujú podľa najvyššieho oxidačného stavu v oxidoch. Každá skupina sa skladá z hlavnej a sekundárnej podskupiny. Medzi hlavné podskupiny patria prvky malých období a prvky veľkých období s rovnakými vlastnosťami. Bočné podskupiny pozostávajú iba z prvkov veľkých období. Chemické vlastnosti prvkov hlavnej a sekundárnej podskupiny sa významne líšia.
Obdobie nazývaný vodorovný rad prvkov usporiadaných vo vzostupnom poradí podľa radových (atómových) čísel. V periodickej sústave je sedem období: prvá, druhá a tretia doba sa nazývajú malé, obsahujú 2, 8 a 8 prvkov; zostávajúce obdobia sa nazývajú veľké: vo štvrtom a piatom období je po 18 prvkoch, v šiestom - 32 a v siedmom (stále nedokončenom) - 31 prvkov. Každé obdobie, okrem prvého, sa začína alkalickým kovom a končí sa vzácnym plynom.
Fyzický význam sériového čísla chemický prvok: počet protónov v atómovom jadre a počet elektrónov otáčajúcich sa okolo atómového jadra sa rovnajú ordinálnemu číslu prvku.
Vlastnosti periodickej tabuľky
Pripomeňme si to v skupinách zvané zvislé riadky v periodickej sústave a chemické vlastnosti prvkov hlavnej a sekundárnej podskupiny sa výrazne líšia.
Vlastnosti prvkov v podskupinách sa prirodzene zhora nadol menia:
- kovové vlastnosti sú vylepšené a nekovové vlastnosti sú oslabené;
- atómový polomer sa zvyšuje;
- zvyšuje sa sila zásad a anoxických kyselín tvorených prvkom;
- elektronegativita klesá.
Všetky prvky, okrem hélia, neónu a argónu, tvoria zlúčeniny kyslíka; existuje iba osem foriem zlúčenín kyslíka. V periodickej tabuľke sú často zobrazené všeobecné vzorceumiestnené pod každou skupinou vo vzostupnom poradí podľa oxidačného stavu prvkov: R 2 O, RO, R 2 O 3, RO 2, R 2 O 5, RO 3, R 2 O 7, RO 4, kde symbol R označuje prvok tejto skupiny. Vzorec pre vyššie oxidy sa vzťahuje na všetky prvky skupiny, s výnimkou výnimočných prípadov, keď prvky nevykazujú oxidačný stav rovný číslu skupiny (napríklad fluór).
Oxidy kompozície R20 vykazujú silné zásadité vlastnosti a ich zásaditosť rastie so zvyšujúcim sa sériovým číslom, oxidy kompozície RO (okrem BeO) vykazujú základné vlastnosti. Oxidy zloženia RO 2, R205, RO3, R207 vykazujú kyslé vlastnosti a ich kyslosť rastie so zvyšujúcim sa sériovým číslom.
Prvky hlavných podskupín, počnúc skupinou IV, tvoria plynné zlúčeniny vodíka. Existujú štyri formy takýchto zlúčenín. Sú umiestnené pod prvkami hlavných podskupín a sú znázornené všeobecnými vzorcami v sekvencii RH4, RH3, RH2, RH.
RH4 zlúčeniny sú neutrálne; RH 3 - slabo zásaditý; RH 2 - mierne kyslý; RH - Silne kyslý charakter.
Pripomeňme si to obdobie nazývaný vodorovný rad prvkov usporiadaných vo vzostupnom poradí podľa radových (atómových) čísel.
V období so zvýšením poradového čísla prvku:
- zvyšuje sa elektronegativita;
- znižujú sa kovové vlastnosti, zvyšujú sa nekovové vlastnosti;
- atómový polomer klesá.

Prvky periodickej tabuľky
Alkalické prvky a prvky alkalických zemín
Patria sem prvky z prvej a druhej skupiny periodickej tabuľky. Alkalické kovy z prvej skupiny - mäkké kovy, striebristý, dobre nakrájame nožom. Všetky majú na vonkajšej obálke jeden jediný elektrón a reagujú perfektne. Kovy alkalických zemín z druhej skupiny majú tiež strieborný odtieň. On externá úroveň umiestnené dva elektróny, a podľa toho sú tieto kovy menej ochotné interagovať s inými prvkami. V porovnaní s alkalickými kovmi sa kovy alkalických zemín topia a varia pri vyšších teplotách.
Zobraziť / skryť text
Lantanidy (prvky vzácnych zemín) a aktinidy
Lanthanidy je skupina prvkov pôvodne nájdených v vzácnych mineráloch; odtiaľ pochádza ich názov „prvky vzácnych zemín“. Následne sa ukázalo, že tieto prvky nie sú také vzácne, ako si pôvodne mysleli, a preto sa prvkom vzácnych zemín priradil názov lanthanoidy. Lanthanidy a aktinidy zaberajú dva bloky, ktoré sú umiestnené pod hlavnou tabuľkou prvkov. Obe skupiny zahŕňajú kovy; všetky lantanoidy (s výnimkou prometia) nie sú rádioaktívne; aktinidy sú naopak rádioaktívne.
Zobraziť / skryť text
Halogény a vzácne plyny
Halogény a vzácne plyny sú zoskupené do skupín 17 a 18 periodickej tabuľky. Halogény sú nekovové prvky, všetky majú vo svojom vonkajšom obale sedem elektrónov. IN vzácne plynyvšetky elektróny sú vo vonkajšom obale, takže sa takmer nepodieľajú na tvorbe zlúčenín. Tieto plyny sa nazývajú „vzácne plyny“, pretože zriedka reagujú s inými prvkami; to znamená, že sa týkajú predstaviteľov ušľachtilej kasty, ktorí sa tradične vyhýbali iným ľuďom v spoločnosti.
Zobraziť / skryť text
Prechodné kovy
Prechodné kovy obsadiť skupiny 3-12 na periodickej tabuľke. Väčšina z nich je hustá, pevná, s dobrou elektrickou a tepelnou vodivosťou. Ich valenčné elektróny (ktorými sa viažu na ďalšie prvky) sú v niekoľkých elektrónových obaloch.
Zobraziť / skryť text
| Prechodné kovy |
| Scandium Sc 21 |
| Titán Ti 22 |
| Vanád V 23 |
| Chróm Cr 24 |
| Mangán Mn 25 |
| Železo Fe 26 |
| Cobalt Co 27 |
| Nikel Ni 28 |
| Meď Cu 29 |
| Zinok Zn 30 |
| Ytrium Y 39 |
| Zirkónium Zr 40 |
| Niób Nb 41 |
| Molybdén Mo 42 |
| Technécium Tc 43 |
| Ruthenium Ru 44 |
| Rhodium Rh 45 |
| Palladium Pd 46 |
| Striebro Ag 47 |
| Kadmium Cd 48 |
| Lu 71 |
| Hafnium Hf 72 |
| Tantal Ta 73 |
| Tungsten W 74 |
| Rhenium Re 75 |
| Osmium Os 76 |
| Iridium Ir 77 |
| Platina Pt 78 |
| Zlato Au 79 |
| Ortuť Hg 80 |
| Lawrence Lr 103 |
| Rutherfordium Rf 104 |
| Dubnium Db 105 |
| Seaborgium Sg 106 |
| Borium Bh 107 |
| Hassius Hs 108 |
| Meitnerium Mt 109 |
| Darmstadty Ds 110 |
| Röntgen Rg 111 |
| Copernicium Cn 112 |
Metaloidy
Metaloidy obsadzujú skupiny 13-16 periodickej tabuľky. Metalloidy ako bór, germánium a kremík sú polovodiče používané na výrobu počítačových čipov a dosiek plošných spojov.
Zobraziť / skryť text
Post-prechodné kovy
Volané prvky post-prechodné kovy, patria do skupín 13-15 periodickej tabuľky. Na rozdiel od kovov nemajú lesk, ale majú matnú farbu. V porovnaní s prechodnými kovmi sú posttransformačné kovy mäkšie, majú ich viac nízka teplota topenie a var, vyššia elektronegativita. Ich valenčné elektróny, s ktorými pripájajú ďalšie prvky, sú umiestnené iba na vonkajšom elektrónovom obale. Prvky skupiny posttransformačných kovov majú oveľa viac vysoká teplota vriaci ako metaloidy.
Teraz si upevnite svoje vedomosti sledovaním videa o periodickej tabuľke a ďalších informáciách.
Skvelé, urobil sa prvý krok k poznaniu. Teraz sa viac menej riadite periodickou tabuľkou a bude to pre vás veľmi užitočné, pretože Mendelejevova periodická sústava je základom, na ktorom stojí táto úžasná veda.







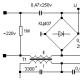


Pripojíme joystick od Dendy k počítaču
Ako vytvoriť televízor z monitora - pokyny krok za krokom
Zariadenie na hľadanie biologicky aktívnych bodov
Automobilová diagnostická sada nástrojov
Ako odstrániť správu VKontakte tak, aby bola odstránená z partnera, ak už bola odoslaná pred jej prečítaním